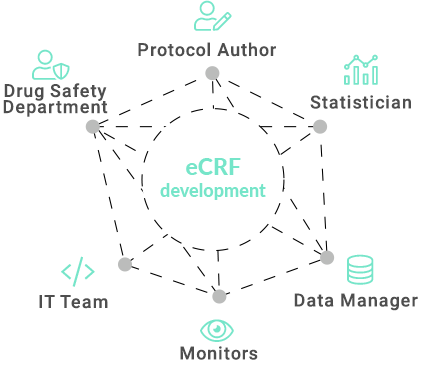
The aim of each study is to collect data that will confirm the hypotheses in the final analysis. The success of the research depends largely on the researcher. The data collection process is extremely complex and it is easy to make mistakes while entering data. The less work on the investigators' side, the greater the chance of engagement. The lower the involvement of the doctor, the worse the quality of the research and data, therefore the overriding goal in the development of eCRF should be improvements for researchers - minimizing their work.


From 20 to 40 percent of the amount of the implementation of a clinical trial is the cost of conducting and
monitoring - employing monitoring specialists who verify the centers and supervise them. Over 80 percent
clinical trials are significantly delayed - this is due to the fact that doctors do not complete the
documentation for the trial sponsor on time, so the sponsor sends monitors to the centers to support the
process.




Frequently asked questions.